5月1日,我校生命科学学院姜巨全教授课题组、中国科学院物理研究所姜道华研究员课题组和清华大学药学院陈立功教授课题组等多家单位合作在国际著名学术期刊《自然•通讯》(Nature Communications,IF 14.7)上合作发表题为“Structure and transport mechanism of human riboflavin transporters”的研究论文。我校生命科学学院博士研究生王柯、博士毕业生陈慧文(现攻读中国科学院物理研究所博士后)、原清华大学药学院陈立功课题组博士后程丽丽、北京大学赵珺、北京望石智慧科技有限公司黄博为本论文的共同第一作者,姜巨全教授、姜道华研究员、陈立功教授为共同通讯作者,我校为第一署名单位。

微生物药物治疗肿瘤是一种新兴的肿瘤治疗方法。人类核黄素转运蛋白在许多癌细胞中过量表达,使其成为微生物药物靶向递送治疗肿瘤的理想靶点。人源核黄素转运蛋白有三种:RFVT1-3,负责核黄素的摄取。核黄素(也叫维生素B2)是RFVT1-3的特异性底物,在能量产生、生物大分子合成和氧化还原等细胞代谢过程中具有关键作用。由于人体无法自身合成维生素B2,只能从外界摄取,故RFVT1-3对细胞正常生命活动过程至关重要。
本研究首先深入分析了RFVT2和RFVT3的功能特性,发现二者对核黄素表现出相似的特异性,但对pH依赖性存在显著差异。为进一步探究导致RFVT2和RFVT3转运机制差异的原因,本研究创新性地使用GFP和纳米抗体作为标记,借助冷冻电镜成功解析了外向过渡状态的RFVT2、内向开放状态的RFVT3与核黄素复合物的高分辨率冷冻电镜结构,为阐明RFVT2和RFVT3的底物转运机制提供了结构基础。
在蛋白结构解析基础上,通过结构分析和功能验证,明确了核黄素在转运蛋白中的结合位点及关键相互作用残基,发现了RFVT3中两个关键酸性残基D119和E145决定其pH依赖性活性的重要分子机制;通过分子动力学模拟,深入探讨了核黄素结合引起的构象变化以及其在不同状态下的结合自由能差异。基于以上研究结果,本研究提出了RFVT1-3转运核黄素的“rocker-switch”机制,完善了对其转运过程的理解。
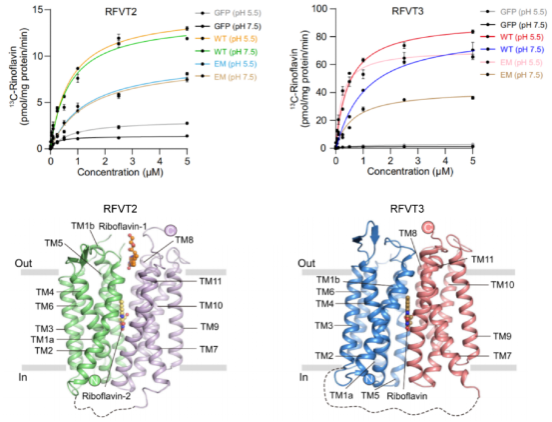
RFVT2和RFVT3的转运特征和结构模型
本研究使用GFP和纳米抗体作为参考标记,借助冷冻电镜解析RFVT2和RFVT3与核黄素转运蛋白复合物结构的有关研究思路,为后续研究者解析类似的小分子量(50 kDa)膜蛋白提供了重要技术指导;本研究所揭示的RFVT 1-3识别和转运核黄素分子机制,为理解核黄素细胞内稳态等相关生理过程奠定了重要理论基础,也为靶向核黄素的微生物药物精准设计/研发提供了创新性研发思路。
本研究是我校在国家“双一流”建设中突出基础学科地位,强化生物学作为支撑学科作用所取得的又一项创新性成果。研究得到了国家自然科学基金、北京市科学技术委员会以及中国科技部国家重点研发计划等项目资助。北京大学现代农业研究院冷冻电镜平台和清华大学药学技术中心为本研究提供了设备支持。

RFVT1-3转运底物的机制模型


左图为王柯博士生,右图为陈慧文博士(现攻读中科院物理所博士后)
王柯为我校生命科学学院2021级在读博士研究生,主要从事膜蛋白结构与功能研究,熟练掌握蛋白纯化、冷冻电镜数据收集处理、结构解析、模型搭建等核心技术,具有扎实的相关理论基础和实际操作经验。陈慧文为我校生命科学学院2019级博士生,现攻读中科院物理所攻读博士后,分别在Nature、Nature Communications以第一作者或共同第一作者发表研究论文5篇,其中Nature共同第一作者(排名第二)1篇,Nature Communications第一作者1篇、共同第一作者(排名第二)2篇、共同第一作者(排名第四)1篇。
姜巨全教授长期从事嗜/耐盐微生物盐碱适应机制并重点关注钠离子转运关键膜蛋白结构及其分子转运机制,以及嗜/耐盐微生物菌剂研发及其盐碱地产业化应用和重要小分子代谢物靶向药物研发等研究工作,是Nature Communications等10余个期刊审稿专家,中国微生物学会农业微生物专业委员会委员,中国土壤学会土壤生物与生化专业委员会委员、黑龙江省微生物学会常务理事;在Nature Communications(3篇)、Journal of Molecular Biology等期刊以第一或通讯作者发表论文35篇,第一完成人授权国家发明专利9件,主编教材3部,副主编教材1部,主持各类科研项目20余项,其中国家自然科学基金联合基金重点项目1项,面上项目4项,青年科学基金项目1项,黑龙江省自然科学基金联合基金重点项目1项。
文章链接:https://www.nature.com/articles/s41467-025-59255-7
(供稿/生命学院)